Forfattere: Leslie Euceda, forsker, og Debbie Hill, senioringeniør.
Brystkreft er et av satsningsområdene ved MR Cancer-gruppen. Det finnes flere stoffer i brystkreftceller som kan gi oss viktig informasjon. For eksempel; dersom reseptorer for hormonene østrogen og progesteron er til stede i en brysttumor, vil pasienten trolig reagere på hormonbehandling. Tilsvarende har noen typer brystkreft store mengder av et protein som heter HER2, som får kreftceller til å øke ukontrollert i antall. Disse pasientene har stor sjanse til å reagere på anti-HER2-terapi. Så er det de typer brystkreft som ikke viser noen av disse egenskapene. Disse er klassifisert som trippel-negativ brystkreft, og responderer ikke på hormonbehandling eller anti-HER2-behandling. Tumorer fra disse pasientene vil vanligvis bli fjernet kirurgisk, men oppfølgingsbehandlingen er begrenset til klassisk kjemoterapi, som er mer aggressiv, påvirker hele kroppen, og dermed gir flere bivirkninger. Selv med denne behandlingen har trippel-negative brystkreftpasienter høy risiko for at kreften kommer tilbake.
Mange forskere og leger rundt om i verden arbeider for å finne bedre behandlinger for trippel-negativ brystkreft. Et potensielt stoff er everolimus. Everolimus blokkerer en bestemt celleprosess som er kjent for å være spesielt aktiv i trippel-negativ brystkreft. Initielle tester av everolimus i musemodeller viste imidlertid at bare omkring halvparten av “pasientene” responderte på behandlingen. Vårt mål var å finne en måte å forutsi hvordan pasienter med trippel-negativ brystkreft vil respondere på everolimusbehandling.
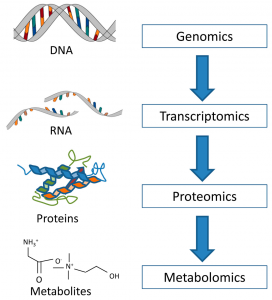
For å kunne forutsi en pasientrespons må vi først forstå hvordan cellene er organisert. Cellene inneholder vår biologiske informasjon strukturert på fire nivåer. Genene, som inneholder instruksjonene for enhver situasjon i cellen, er på første nivå. Som svar på en bestemt situasjon, blir visse gener uttrykt, og sender en melding med en handlingsplan. De uttrykte genene, RNA, utgjør det andre nivået. RNA gir en instruksjon om aktivering eller syntese av cellens “arbeidere”, proteiner, som er på tredje nivå. Hormonreseptorene og HER2-proteinet er eksempler på proteiner. Til slutt, mens proteiner gjør sitt arbeid, vil de produsere forskjellige materialer. Noen av disse kan være nyttige, mens andre bare er avfall. Disse materialene er det vi kaller metabolitter; de er på fjerde og siste nivå.
Ved å utgjøre det laveste nivået av biologisk informasjon, er metabolitter nærmere de faktiske observerbare egenskapene til cellen. Metabolittnivåene i cellene er også påvirket av eksterne faktorer som miljø, mosjon og kosthold. Så, metabolitter kan gi oss en annen informasjon enn de andre nivåene. For eksempel kan alt være i orden med instruksjonene fra genene, mens de “ansatte” (proteiner) kan være syke. Eventuelt kan de “ansatte” ha det bra, mens “materialene” (metabolittene) kan være gått ut på dato. Vi lurte derfor på om målinger av metabolitter kan gi oss informasjon som kan bidra til å forutsi responsen på everolimus.
Vi målte metabolitter i over 100 trippel-negative brysttumorer ved bruk av Magnetisk resonans (MR) spektroskopi [1]. Tumorprøver ble tatt fra trippel-negative brystkreftpasienter, og deretter transplantert til mus for å bevare de humane svulstegenskaper. Enkelte svulster ble behandlet med everolimus, mens andre forble ubehandlet. Dette tillot oss å undersøke effekten av everolimus under kontrollerte forhold, noe som ikke ville være mulig hos mennesker. Vi fant klare metabolittforskjeller mellom tumorene som ble behandlet med everolimus og de som ikke var behandlet, noe som betyr at everolimus hadde effekt på tumormetabolisme. Dessverre kunne vi ikke forutsi hvilke mus som responderte godt på everolimus basert bare på metabolittmålingene. Likevel fant vi at metabolittene endres ulikt på everolimusbehandling hos responderende og ikke-responderende mus. Forskjellene vi fant tyder på at pasienter som responderer godt på behandling med everolimus vil ha kraftigere metabolske responser enn dem som ikke har effekt av behandlingen.
Tidligere studier hos MR Cancer-gruppen har vist at trippel-negative brysttumorer hos mus har forskjellige metabolittegenskaper sammenlignet med andre brystkrefttyper med en bedre prognose [2], og at disse subtypene endres på ulikt vis ved behandling [3]. Vi undersøker nå om vi kan se det samme i trippel-negative brysttumorer fra menneskelige pasienter.
Det ultimate målet med arbeidet er å forbedre kreftbehandling og pasientomsorg, og vi kunne ikke gjøre det uten finansiering fra organisasjoner som Forskningsrådet, Kreftforeningen, og Regionalt samarbeidsorgan for utdanning, forskning og innovasjon mellom Helse Midt-Norge RHF og NTNU.
Hvis du føler deg engasjert i saken, ikke nøl med å bli involvert! Enten det bare er å bære rosa eller delta i hendelser i nærheten av deg som støtter kampen mot brystkreft. Bli med å spre det viktige budskapet!
Denne saken ble først publisert på NTNU Medisin og Helse Fagblogg.
Referanser
- Euceda LR, Hill DK, Stokke E, Hatem R, El Botty R, Bieche I et al. Metabolic Response to Everolimus in Patient-Derived Triple-Negative Breast Cancer Xenografts. J Proteome Res. 2017;16(5):1868-79. doi:10.1021/acs.jproteome.6b00918.
- Grinde M, Skrbo N, Moestue S, Rødland E, Borgan E, Kristian A, et al. Interplay of choline metabolites and genes in patient-derived breast cancer xenografts. Breast Cancer Res. 2014;16:1-16.
- Moestue SA, Dam CG, Gorad SS, Kristian A, Bofin A, Mælandsmo GM et al. Metabolic biomarkers for response to PI3K inhibition in basal-like breast cancer. Breast Cancer Res. 2013;15:R16.